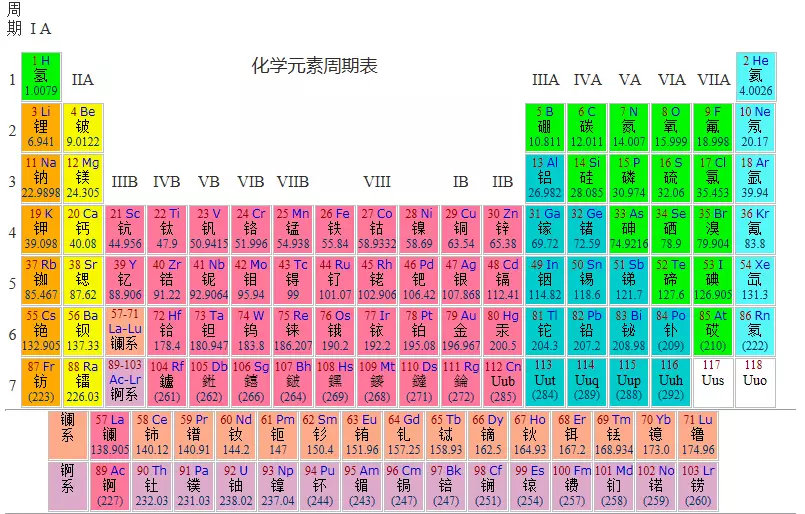
化学元素周期表
元素周期表是化学的"地图",它将所有已知的化学元素按照一定的规律排列在一起。就像地图帮助你找到地理位置一样,元素周期表帮助你理解元素的性质和规律。这张表看似简单,却蕴含着深刻的化学规律,是学习化学的重要工具。
什么是元素周期表?
元素周期表(Periodic Table)是按照原子序数(质子数)递增的顺序,将化学元素排列成表格的形式。它揭示了元素性质的周期性变化规律。
元素周期表的历史
- 1869 年:俄国化学家 [门捷列夫](https://zh.wikipedia.org/ wiki/ %E5%BE%B7%E7%B1%B3%E7%89%B9%E9%87%8C%C2%B7%E9%97%A8%E6%8D%B7%E5%88% 97%E5%A4%AB)(Dmitri Mendeleev)首次提出元素周期表
- 门捷列夫的贡献:他根据原子量和化学性质排列元素,并预测了未知元素的存在
- 现代周期表:现在按照原子序数(质子数)排列,更加准确
有趣的故事:门捷列夫在梦中看到了元素周期表的排列方式,醒来后立即记录下来。这个故事告诉我们,有时候灵感来自长期的思考和积累!
元素周期表的结构
周期(Periods)
周期是元素周期表中的横行,共有 7 个周期。
- 第一周期:2 个元素(H、He)
- 第二周期:8 个元素(Li 到 Ne)
- 第三周期:8 个元素(Na 到 Ar)
- 第四周期:18 个元素(K 到 Kr)
- 第五周期:18 个元素(Rb 到 Xe)
- 第六周期:32 个元素(Cs 到 Rn)
- 第七周期:32 个元素(Fr 到 Og,部分为人工合成)
规律:周期数 = 元素的最外层电子层数
族(Groups)
族是元素周期表中的纵列,共有 18 个族。
主族(A 族)
- IA 族(碱金属):Li、Na、K、Rb、Cs、Fr
- IIA 族(碱土金属):Be、Mg、Ca、Sr、Ba、Ra
- IIIA 族:B、Al、Ga、In、Tl
- IVA 族:C、Si、Ge、Sn、Pb
- VA 族:N、P、As、Sb、Bi
- VIA 族(氧族):O、S、Se、Te、Po
- VIIA 族(卤素):F、Cl、Br、I、At
- 0 族(稀有气体):He、Ne、Ar、Kr、Xe、Rn
副族(B 族)
- 过渡金属:包括 IIIB 到 IIB 族,如 Fe、Cu、Zn 等
元素周期律
元素周期律是指元素的性质随着原子序数的递增而呈现周期性变化的规律。
1. 原子半径的周期性变化
- 同一周期:从左到右,原子半径逐渐减小
- 原因:核电荷数增加,对电子的吸引力增强
- 同一族:从上到下,原子半径逐渐增大
- 原因:电子层数增加
例子:
- 第一周期:H > He
- 第二周期:Li > Be > B > C > N > O > F > Ne
- IA 族:Li < Na < K < Rb < Cs
2. 电离能的周期性变化
电离能是使原子失去一个电子所需的能量。
- 同一周期:从左到右,电离能逐渐增大
- 原因:原子半径减小,核电荷数增加,电子更难失去
- 同一族:从上到下,电离能逐渐减小
- 原因:原子半径增大,最外层电子离核更远,更容易失去
例子:
- 第二周期:Li < Be < B < C < N < O < F < Ne
- IA 族:Li > Na > K > Rb > Cs
3. 电负性的周期性变化
电负性是原子吸引电子的能力。
- 同一周期:从左到右,电负性逐渐增大
- 同一族:从上到下,电负性逐渐减小
电负性最大的元素:F(氟),电负性为 4.0 电负性最小的元素:Fr(钫),电负性约为 0.7
4. 金属性和非金属性的周期性变化
- 同一周期:从左到右,金属性逐渐减弱,非金属性逐渐增强
- 同一族:从上到下,金属性逐渐增强,非金属性逐渐减弱
分界线:在周期表中,有一条从 B 到 At 的"阶梯线",这条线左边的元素主要是金属,右边的元素主要是非金属。
常见元素及其应用
1. 氢(H)
- 位置:第一周期,IA 族
- 性质:最轻的元素,易燃,是宇宙中最丰富的元素
- 应用:燃料电池、火箭燃料、工业原料
2. 碳(C)
- 位置:第二周期,IVA 族
- 性质:可以形成多种同素异形体(金刚石、石墨、富勒烯)
- 应用:钢铁、石墨电极、碳纤维、半导体材料
3. 氮(N)
- 位置:第二周期,VA 族
- 性质:无色、无味气体,化学性质不活泼
- 应用:化肥、炸药、电子工业(氮气保护)
4. 氧(O)
- 位置:第二周期,VIA 族
- 性质:无色、无味气体,支持燃烧
- 应用:呼吸、燃烧、氧化反应、医疗
5. 硅(Si)
- 位置:第三周期,IVA 族
- 性质:半导体,是地壳中第二丰富的元素
- 应用:半导体工业(芯片、晶体管)、太阳能电池、玻璃
6. 磷(P)
- 位置:第三周期,VA 族
- 性质:有多种同素异形体,易燃
- 应用:化肥、火柴、LED 材料
7. 硫(S)
- 位置:第三周期,VIA 族
- 性质:黄色固体,有特殊气味
- 应用:硫酸生产、橡胶硫化、农药
8. 氯(Cl)
- 位置:第三周期,VIIA 族
- 性质:黄绿色气体,有毒,强氧化性
- 应用:消毒、漂白、塑料生产(PVC)
9. 铁(Fe)
- 位置:第四周期,VIII 族(过渡金属)
- 性质:银白色金属,易生锈
- 应用:钢铁、磁铁、血红蛋白
10. 铜(Cu)
- 位置:第四周期,IB 族(过渡金属)
- 性质:紫红色金属,良好的导电性和导热性
- 应用:电线、电路板、合金、管道
11. 锌(Zn)
- 位置:第四周期,IIB 族(过渡金属)
- 性质:蓝白色金属,易氧化
- 应用:电池(锌锰电池)、镀锌、合金
元素周期表在 STEM 项目中的应用
1. 半导体材料选择
在电子项目中,你经常使用半导体材料:
- 硅(Si):最常用的半导体,用于制造芯片、晶体管
- 锗(Ge):早期半导体材料,现在主要用于特殊应用
- 砷化镓(GaAs):用于高频电子器件、LED
为什么选择这些元素?
- 它们位于周期表的金属和非金属分界线附近
- 具有半导体的特性:导电性介于导体和绝缘体之间
- 可以通过掺杂(添加其他元�素)来改变导电性
2. 电池材料选择
理解元素周期表有助于选择合适的电池材料:
- 锂(Li):用于锂离子电池,因为锂是最轻的金属,电负性低
- 锌(Zn):用于锌锰电池,因为锌的化学活性适中
- 铅(Pb):用于铅酸电池,因为铅的化学性质稳定
选择原则:
- 负极材料:选择电负性低的元素(容易失去电子)
- 正极材料:选择电负性高的元素(容易获得电子)
3. 传感器材料
许多传感器依赖于特定元素的性质:
- 气体传感器:
- 一氧化碳传感器:使用铂(Pt)等贵金属作为催化剂
- 氢气传感器:使用钯(Pd),因为钯可以吸收氢气
- 温度传感器:
- 热敏电阻:使用过渡金属氧化物,如氧化镍、氧化钴
- 光传感器:
- 光电二极管:使用硅(Si)或锗(Ge)
4. 材料工程
理解元素周期表�有助于选择合适的材料:
- 导电材料:选择金属元素,特别是过渡金属(Cu、Al、Ag)
- 绝缘材料:选择非金属元素的化合物(如 、)
- 磁性材料:选择铁、钴、镍等过渡金属及其化合物
5. 3D 打印材料
3D 打印使用的材料涉及多种元素:
- PLA:主要含碳、氢、氧
- ABS:主要含碳、氢、氮
- 金属打印:使用钛、铝、不锈钢等金属元素
理解这些元素的化学性质有助于选择合适的打印参数和后处理工艺。
如何记忆元素周期表?
1. 记住前 20 个元素
这是最常用的元素,建议熟记:
第一周期:H(氢)、He(氦) 第二周期:Li(锂)、Be(铍)、B(硼)、C(碳)、N(氮)、O(氧)、F(氟)、Ne(氖) 第三周期:Na(钠)、Mg(镁)、Al(铝)、Si(硅)、P(磷)、S(硫)、Cl(氯)、Ar(氩) 第四周期:K(钾)、Ca(钙)
2. 记住常见族
- IA 族(碱金属):Li、Na、K、Rb、Cs
- VIIA 族(卤素):F、Cl、Br、I
- 0 族(稀有气体):He、Ne、Ar、Kr、Xe
3. 记住过渡金属
- 第一过渡系:Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu、Zn
- 常用金属:Fe(铁)、Cu(铜)、Zn(锌)、Al(铝)
小结
元素周期表是化学的重要工具:
- 周期:横行,共有 7 个周期
- 族:纵列,共有 18 个族
- 元素周期律:元素性质随原子序数呈现周期性变化
- 常见元素:H、C、N、O、Si、Fe、Cu、Zn 等在 STEM 项目中广泛应用
理解元素周期表不仅有助于学习化学,还能帮助你在实际项�目中选择合适的材料、设计传感器、优化电池性能。这张看似简单的表格,实际上蕴含着丰富的化学知识!
💡 小贴士:你可以打印一张元素周期表放在工作台上,经常查阅。随着学习的深入,你会发现这张表越来越有用!